티스토리 뷰
목차
앙투안 라부아지에(Antoine-Laurent Lavoisier, 1743–1794)는 현대 화학의 기초를 다진 프랑스의 과학자입니다. 그는 법학을 전공했으나 화학에 대한 열정으로 자연과학 연구에 몰두했습니다. 1771년, 재정적으로 유복한 Marie-Anne Pierrette Paulze와 결혼하여 그녀의 도움으로 다양한 화학 실험과 연구를 수행했습니다. 라부아지에는 산소, 수소, 질소의 명명법을 체계화하고, 질량 보존의 법칙을 확립하는 데 중요한 기여를 했습니다.

위의 초상화에는 많은 내용이 담겨 있습니다. 1788년, 프랑스 혁명의 시대가 열리기 시작할 때 당시 프랑스에서 가장 유명한 예술가인 Jacques-Louis David (1748–1825)에 의해 그려진 작품이다. 이 초상화의 중심인물은 라부아지에 아내이며, 그녀는 남편과 함께 한 과학적 공헌을 널리 알리는 데 중요한 역할을 했습니다. 남편의 죽음 후에도 미완성된 "Mémoires de chimie"의 자료를 수집하여 1805년에 논문들을 출판했습니다. 이 논문들은 라부아지에의 연구에 대한 최종 해석을 담고 있었습니다. 라부아지 아내는 남편의 발견을 지속적으로 홍보하며 파리의 과학 세계에서 중요한 인물로 남았습니다(출처: Science History Institute).
주요 저서와 논문
그의 저서와 논문은 다음과 같은 자료들이 있으며 개략적인 내용을 설명하고자 합니다.
"Traité Élémentaire de Chimie" (1789)
- 이 책은 Lavoisier의 가장 유명한 저서로, 현대 화학의 기초를 다진 작품입니다. 이 책에서 그는 질량 보존의 법칙을 포함한 다양한 화학 법칙과 개념을 체계적으로 설명합니다. 이 책은 종종 "Elements of Chemistry"로 번역되어 있습니다. 책의 주요 내용으로는 화학적 명명법의 도입, 실험적 방법론, 그리고 질량 보존의 법칙에 대한 설명이 포함되어 있습니다.
- 영어 표현: Elementary Treatise of Chemistry(화학 기초 논문)
"Mémoire sur la combustion en général" (1777)
- 이 논문에서 Lavoisier는 연소 과정에 대한 그의 초기 연구를 다루며, 질량 보존의 법칙의 기초가 되는 개념을 제시합니다. 그는 이 논문에서 연소가 산소와의 화학 반응임을 증명하였습니다.
- 영어 표현: Memoir on Combustion in General(일반 연소에 관한 논문)
"Réflexions sur le Phlogistique" (1783)
- 이 논문에서 Lavoisier는 당시 널리 받아들여지던 플로지스톤 이론을 비판하며, 이를 대체하는 새로운 이론을 제안합니다. 이 논문은 질량 보존의 법칙을 포함한 그의 화학 이론의 중요한 부분을 설명합니다.
- 영어 표현: Reflections on Phlogiston(플로지스톤에 대한 성찰)
화학 명명법의 정립 및 체계적 분류
라부아지에는 화학의 체계화에 중요한 기여를 했으며, 이는 화학 명명법의 혁신에서 특히 두드러집니다. 그는 원소 이름을 제안하고 체계화하여 오늘날 우리가 사용하는 화학 명칭의 기초를 마련했습니다.18세기 말, 화학은 여전히 혼란스러운 상태였습니다. 여러 물질들이 다양한 이름으로 불리고 있었고, 명명법에 일관성이 없었습니다. 라부아지에는 화학을 보다 체계적이고 이해하기 쉽게 만들기 위해 새로운 명명법을 개발하기로 결정했습니다.
1. 산소 (Oxygen)
- 배경: Lavoisier는 Joseph Priestley가 발견한 "탈플로지스톤 공기"가 실제로 연소를 촉진하는 데 중요한 역할을 한다는 것을 알게 되었습니다.
- 이름: 그는 이 기체를 "산소"라고 이름 붙였습니다. 이는 그리스어로 "산(acid)"을 의미하는 "oxys"와 "생산(produce)"을 의미하는 "genes"의 합성어로, "산을 생성하는"이라는 뜻입니다. 당시 Lavoisier는 모든 산이 산소를 포함하고 있다고 믿었습니다.
2. 수소 (Hydrogen)
- 배경: Lavoisier는 Henry Cavendish가 발견한 "인화성 공기"가 물의 중요한 구성 요소라는 것을 알게 되었습니다.
- 이름: 그는 이 기체를 "수소"라고 이름 붙였습니다. 이는 그리스어로 "물(water)"을 의미하는 "hydro"와 "생성(produce)"을 의미하는 "genes"의 합성어로, "물을 생성하는"이라는 뜻입니다.
3. 질소 (Nitrogen)
- 배경: Lavoisier는 대기의 대부분을 차지하는 이 기체가 연소를 지원하지 않으며 생명 유지에 필수적이지 않다는 것을 알게 되었습니다.
- 이름: 그는 이 기체를 "질소"라고 이름 붙였습니다. 이는 그리스어로 "소다"를 의미하는 "nitron"과 "생성(produce)"을 의미하는 "genes"의 합성어로, "소다를 생성하는"이라는 뜻입니다. 당시 질소 화합물이 소다에서 발견된다는 것을 근거로 한 명칭입니다.
4. 화학 명명법의 정립
Lavoisier는 다른 화학자들과 함께 새로운 명명법을 제안하고 이를 체계화했습니다. 이 명명법은 다음과 같은 원칙에 기반을 두고 있습니다.
- 일관성: 모든 원소와 화합물의 이름은 그 성질과 구성 요소를 반영해야 합니다.
- 명확성: 화합물의 이름은 그 화학적 조성에 대해 명확한 정보를 제공해야 합니다.
- 국제성: 모든 화학자들이 동일한 명명법을 사용하여 서로 소통할 수 있어야 합니다.
라부아지에의 체계적 원소 분류
Antoine-Laurent Lavoisier는 원소들을 체계적으로 분류하고, 이를 바탕으로 화합물 형성과 화학 반응을 설명하는 데 중요한 기여를 했습니다. 그의 접근법은 현대 화학의 기초를 확립하는 데 결정적인 역할을 했으며, 다음과 같은 방식으로 체계적 분류를 수행했습니다. 첫째, 금속과 비금속의 분류입니다.
금속 (Metals)과 비금속을 다음과 같이 정의하였습니다.
| 구분 | 금속 | 비금속 |
| 특징 | 전형적인 광택 전기와 열을 잘 전도 고체 상태에서 연성과 전성이 뛰어남 |
일반적으로 광택이 없음 전기와 열의 전도성이 낮음 다양한 물리적 상태(고체, 액체, 기체)로 존재함 |
| 예시 | 철(Fe), 구리(Cu), 금(Au) 등 | 산소(O), 질소(N), 황(S) 등 |
Lavoisier는 이 두 가지 카테고리로 원소를 분류함으로써 화학자들이 물질의 특성과 반응성을 이해하는 데 도움을 주었습니다. 둘째, 화합물 형성의 체계적인 설명입니다. Lavoisier는 원소들이 어떻게 화합물을 형성하는지를 설명하기 위해 명확한 분류와 명명법을 도입했습니다. 그는 각 원소가 다른 원소들과 결합하여 다양한 화합물을 생성하는 방식을 체계적으로 설명했습니다.
| 구분 | 형성 | 예시 |
| 산화물 (Oxides) | 금속 또는 비금속이 산소와 결합하여 생성 | 이산화탄소(CO2), 산화철(Fe2O3) |
| 산 (Acids) | 비금속 산화물이 물과 결합하여 형성 | 황산(H2SO4), 염산(HCl) |
| 염기 (Bases) | 금속 산화물이 물과 결합하여 형성 | 수산화나트륨(NaOH), 수산화칼슘(Ca(OH)2) |
| 염 (Salts) | 산과 염기가 반응하여 생성 | 염화나트륨(NaCl), 황산칼슘(CaSO4) |
셋째, 화학 반응을 체계적으로 설명하였습니다. 라부아지에는 원소와 화합물의 분류를 바탕으로 화학 반응을 체계적으로 설명했습니다. 그는 화학 반응에서 일어나는 물질의 변화를 질량 보존의 법칙을 통해 설명했으며, 이를 통해 복잡한 화학 반응을 이해하고 예측할 수 있도록 도왔습니다. 그 대표적인 예가 질량 보존의 법칙입니다. 화학 반응 전후에 물질의 총 질량은 변하지 않습니다. 이는 화학 반응에서 물질이 생성되거나 소멸되지 않고, 단지 다른 형태로 변환된다는 것을 의미합니다.
라부아지에의 실험 및 방법론
라부아지에는 그의 연구에서 정확한 실험과 정량적 분석을 중시했습니다. 그는 실험실에서 다양한 기기를 사용하여 화학 반응을 연구했고, 이를 통해 얻은 데이터를 바탕으로 화학 법칙을 정립했습니다. 그의 주요 실험 기법은 다음과 같습니다:
1. 기체 수집 장치
- 라부아지에는 기체의 발생과 반응을 연구하기 위해 다양한 기체 수집 장치를 개발했습니다. 그는 이를 통해 기체의 부피와 질량을 정확히 측정하고, 기체의 화학적 성질을 연구했습니다.
- 수은 기체 수집 장치: Lavoisier는 수은을 이용한 기체 수집 장치를 이용하여 기체의 부피를 정확히 측정하고, 이를 통해 기체의 화학적 성질을 연구했습니다. 이 장치는 기체가 수은 위로 떠오르도록 설계되어, 기체의 순도를 유지하면서도 쉽게 분석할 수 있도록 했습니다.
- 물 합성 실험 장치: Lavoisier는 수소와 산소를 결합하여 물을 생성하는 실험을 진행했으며, 이 과정에서 발생하는 기체를 수집하고 분석할 수 있는 장치를 사용했습니다. 이 장치는 두 개의 기체를 정확한 비율로 혼합하고, 반응 후 생성된 물을 수집할 수 있도록 설계되었습니다.

Fig. 16, Fig. 17: 실험 중 발생하는 가스를 수집하는 기구. 기체가 수집되어 다른 반응에 사용될 수 있습니다.
Fig. 18, Fig. 19, Fig. 20: 기체를 모으고 저장하는 다양한 용기와 연결관. 기체의 정확한 부피를 측정하는 데 사용됩니다.
Fig. 21, Fig. 22, Fig. 23: 반응기의 부속품들. 기체가 안전하게 수집되고 분석될 수 있도록 설계되었습니다.

- Fig. 1 - Fig. 4: 연소 및 증류 장비. 이 장비들은 기체를 발생시키고, 이를 다른 용기로 이동시켜 수집하는 데 사용되었습니다. 각 장비는 기체의 이동 경로와 반응 용기를 연결하는 데 중요한 역할을 합니다.
- Fig. 5 - Fig. 9: 기체 수집 용기. 여러 개의 연속된 기체 수집 용기들이 연결되어 있으며, 각 용기는 발생한 기체를 차례로 수집하여 분석할 수 있도록 설계되었습니다. 이는 Lavoisier가 다양한 기체를 분리하고 특성을 연구하는 데 사용한 중요한 방법입니다.
- Fig. 10 - Fig. 14: 추가 실험 장비. 여기에는 기체를 모으고 측정하기 위한 다양한 추가 장비들이 포함되어 있습니다. 예를 들어, 기체를 냉각시켜 응축시키는 장치와, 기체의 정확한 부피를 측정할 수 있는 장비들이 있습니다.
- Fig. 15 - Fig. 18: 혼합 및 반응 장비. 혼합기와 반응기는 화학 물질을 혼합하고 반응시키는 데 사용되며, 생성된 기체를 수집하기 위해 특별히 설계되었습니다. 이 장비들은 정확한 화학 분석을 가능하게 합니다.
- Fig. 19 - Fig. 23: 다양한 형태의 용기. 여러 형태의 용기들은 실험 조건에 맞게 기체를 저장하고 이동시키는 데 사용됩니다. 이는 실험 결과의 신뢰성을 높이는 데 중요합니다.
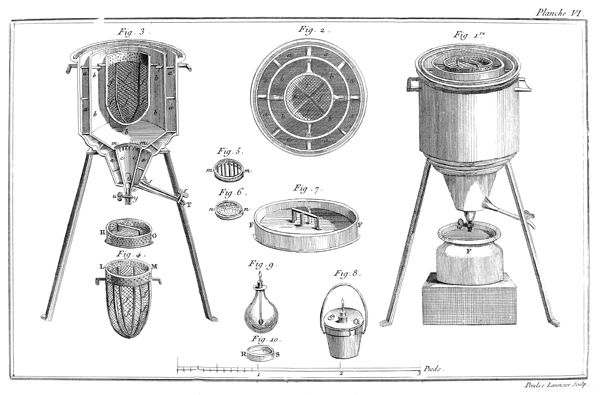
- Fig. 1, Fig. 2: 기체 수집 욕조. 이 장비들은 기체 수집을 위한 물이나 수은이 채워진 욕조입니다. 발생한 기체는 물 또는 수은의 표면 위로 떠올라 다른 용기에 모아지게 됩니다.
- Fig. 3: 수은 기체 수집 장치. 이 장치는 수은을 이용해 기체를 수집하는 장비입니다. 발생한 기체는 수은을 통해 이동하여 다른 용기에 모아집니다.
- Fig. 4: 기체 저장 통. 기체를 수집한 후 저장하는 통으로, 기체의 양을 정확히 측정하고 보관할 수 있습니다.
- Fig. 5: 유리관과 용기. 유리관과 용기는 기체를 정확하게 이동시키고, 필요한 실험에 사용할 수 있도록 설계되었습니다.
- Fig. 6: 측정 장치. 기체의 부피를 정확하게 측정하기 위한 장치로, 실험의 정확성을 높이는 데 사용됩니다.
- Fig. 7: 기체 발생 장치. 이 장치는 화학 반응을 통해 기체를 발생시키는 데 사용됩니다. 발생한 기체는 수집 장치로 이동하여 저장됩니다.
- Fig. 8, Fig. 9: 기체 분석 장치. 기체의 성분을 분석하기 위한 장비로, 다양한 화학적 특성을 연구하는 데 사용됩니다.
2. 연소 실험
Antoine Lavoisier는 금속의 연소 과정을 연구하기 위해 다양한 실험을 수행했으며, 이를 통해 금속이 연소할 때 산소와 결합하여 산화물이 생성된다는 것을 증명했습니다. 그의 연구는 연소의 본질을 이해하고 현대 화학의 기초를 마련하는 데 중요한 역할을 했습니다. 아래는 그의 연소 실험 과정에 대한 상세한 설명입니다.
장비 설치: 연소 실험을 위한 대형 증류 장치와 기체 수집 장치를 준비합니다. 금속을 담을 수 있는 용기와 이를 가열할 수 있는 보일러를 설치합니다. 기체가 발생하고 이동할 수 있도록 연결 파이프를 준비합니다.
금속 준비: Lavoisier는 다양한 금속(예: 철, 주석, 납 등)을 실험 대상으로 선택했습니다. 이 때 금속의 초기 질량을 정확히 측정합니다.
연소: 금속을 연소 용기에 넣고, 보일러를 사용하여 가열합니다. 연소 과정에서 금속은 산소와 반응하여 산화물을 형성합니다. 이때, 금속은 산소와 결합하여 질량이 증가합니다.
기체 수집: 연소 과정에서 발생하는 기체를 수집합니다. 파이프와 유리관을 통해 발생한 기체를 이동시키고, 기체 수집 장치에 저장합니다. 기체 수집 장치는 수은을 이용하여 기체의 부피를 정확히 측정할 수 있습니다.
분석: 연소 후 금속의 질량을 다시 측정합니다. 연소 전후의 질량 변화를 비교하여, 금속이 산소와 결합하여 산화물이 생성되었음을 확인합니다. 수집된 기체의 성분을 분석하여, 주로 산소가 연소 과정에서 소비되었음을 증명합니다.
실험 결과
질량 보존의 법칙: 연소 과정에서 물질의 총 질량은 변하지 않으며, 이는 질량 보존의 법칙을 입증하는 중요한 근거가 되었습니다. 물질은 생성되거나 소멸되지 않고, 단지 다른 형태로 변환될 뿐임을 증명했습니다.
산소의 역할: 금속이 연소할 때 산소와 결합하여 산화물이 생성된다는 것을 입증했습니다. 이는 연소가 산소와의 화학 반응임을 증명하며, 플로지스톤 이론을 대체하는 새로운 이론을 제시하는 데 중요한 역할을 했습니다.
3. 분석 저울
- 라부아지에는 정확한 질량 측정을 위해 분석 저울을 사용했습니다. 그는 화학 반응 전후의 물질의 질량을 측정하여 질량 보존의 법칙을 입증했습니다.
물은 산소와 수소의 화합물이다.
그의 실험 방식을 따라가는 방식으로 구성하여 보았습니다. 라부아지에가 11월 12일 왕립 과학 아카데미 공개회의에서 발표한 보고서에 대한 내용입니다. 이 보고서는 물의 성질과 물이 엄밀히 말해서 원소가 아니라 분해와 재구성이 가능하다는 것을 증명하는 것처럼 보이는 실험들에 대해 다루고 있습니다. 앙투안 로랑 드 라부아지에가 수행한 수소와 산소의 연소 실험은 화학반응과 관련된 중요한 발견을 가져왔습니다. 다음은 그가 사용한 방법에 대한 설명입니다.
1. 실험 준비
- 용기 준비: 라부아지에는 반응을 관찰하기 위해 유리 용기를 사용했습니다. 이 유리 용기는 밀폐가 가능하여, 반응 중에 발생하는 가스의 손실을 방지할 수 있었습니다.
- 가스 수집: 수소 가스와 산소 가스를 각각 다른 방법으로 수집했습니다. 수소는 금속과 산의 반응을 통해, 산소는 수은(II) 산화물의 가열 분해를 통해 얻었습니다.

2. 실험 방법
- 가스 혼합: 수소 가스와 산소 가스를 정확한 비율로 혼합했습니다. 그는 이론적 계산에 따라 수소와 산소를 2:1의 몰 비율로 혼합하는 것이 이상적임을 밝혀냈습니다. 하지만 초기 실험은 정확한 비율을 고려하지 않고 수행하였습니다.
- 반응 유도: 혼합 가스를 유리 용기에 넣고, 불꽃이나 전기 스파크를 사용하여 혼합 가스에 점화했습니다. 이 점화는 강력한 반응을 일으키며, 수소와 산소가 빠르게 반응하여 물을 형성합니다.
3. 실험 관찰 및 측정
- 반응 관찰: 반응이 진행되는 동안 발생하는 열과 빛을 관찰했습니다. 또한, 반응 후 남은 가스의 양을 측정하여 질량 보존 법칙을 확인했습니다.
- 물의 수집: 반응을 통해 생성된 물은 용기의 벽에 응축되었고, 이 응축된 물의 양과 질량을 정밀하게 측정했습니다.
4. 실험의 의의
- 이 실험을 통해 라부아지에는 수소와 산소가 결합하여 물을 형성한다는 중요한 발견을 하였습니다.
- 이는 물이 단순한 원소가 아니라 화합물임을 입증하는 데 중요한 증거가 되었으며, 화학적 연소의 본질을 이해하는 데 큰 진전을 가져왔습니다.
- 또한, 질량 보존의 법칙을 확립하는 데 결정적인 역할을 했습니다. 이 실험은 화학의 정량적 분석 방법과 원소 조합의 원리를 확립하는 데 큰 기여를 했으며, 현대 화학의 기초를 마련하는 데 중요한 역할을 했습니다.
아래의 내용의 라부아지에의 화학의 기초에 나오는 수소와 산소 화학반응 원문 번역
(출처: https://www.gutenberg.org/files/52489/52489-h/52489-h.htm#ch8)
composition de l'eau
1. 준비
- 발롱 준비: 큰 개구부가 있는 약 30핀트 용량의 크리스탈 발롱 A를 준비합니다. 이 발롱에는 네 개의 구멍이 뚫린 구리판 BC가 밀봉되어 있으며, 이 구멍으로 네 개의 튜브가 연결됩니다.
- 첫 번째 튜브 Hh: 이 튜브는 공기 펌프에 연결되어 발롱에서 공기를 펌핑하여 공기를 빼냅니다.
- 두 번째 튜브 gg: 이 튜브는 산소 가스 저장소와 연결되어 발롱에 산소를 공급합니다.
- 세 번째 튜브 dDd': 이 튜브는 수소 가스 저장소와 연결되며, 매우 작은 구멍을 통해 수소 가스가 저장소에서 충분한 속도로 밀려나오도록 합니다. 이 속도는 한두 인치 물의 압력으로 조절됩니다.
- 네 번째 튜브와 금속선 GL: 이 튜브는 구리판의 네 번째 구멍에 밀봉되어 있으며, 금속선 GL이 통과합니다. 금속선의 끝 L에는 작은 구슬이 달려 있어, L에서 d'까지 전기 스파크를 발생시켜 수소 가스에 불을 붙일 수 있습니다. 금속선 GL은 움직일 수 있어 구슬 L을 튜브 dDd'의 끝 d'에서 멀어지게 할 수 있습니다.
- 튜브 조절: 세 개의 튜브 dDd', gg, Hh는 각각의 수도꼭지가 있어 가스의 흐름을 조절합니다.
2. 가스의 건조
- 산소 가스와 수소 가스는 발롱 A로 보내기 전에 각각의 튜브 MM, NN을 통과합니다. 이 튜브들은 직경이 약 한 인치이며, 공기 중의 수분을 강하게 끌어당기는 소금(아세테이트 칼륨, 염화 또는 질산 칼슘)으로 채워져 있습니다. 이 소금들은 거친 가루 형태여야 하며, 덩어리를 지어 가스가 통과하지 못하게 해서는 안 됩니다.
3. 가스의 준비
- 미리 충분한 양의 순수한 산소 가스를 준비합니다. 산소가 이산화탄소를 포함하지 않도록, 오랫동안 수용액에 담긴 칼륨과 접촉시킨 후 칼륨을 석회로 탈산화시킵니다.
- 같은 방법으로 수소 가스 두 배량을 준비합니다. 가장 안전한 방법은 매우 순수하고 연성이 좋은 철을 사용하여 물을 분해함으로써 수소 가스를 얻는 것입니다.
4. 실행
- 이 두 가스가 준비되면, 공기 펌프를 튜브 Hh에 연결하고 발롱 A에서 공기를 빼냅니다. 그 다음 산소 가스를 튜브 gg를 통해 발롱에 도입하고, 압력을 사용하여 수소 가스를 튜브 dDd'를 통해 발롱으로 보냅니다. 수소 가스의 끝이 뾰족해지면, 전기 스파크로 이 가스에 불을 붙입니다. 이렇게 두 가스의 연소를 오랫동안 계속할 수 있습니다. 필요에 따라 가스를 계속 공급할 수 있습니다.
5. 실험 결과
- 연소가 진행됨에 따라, 발롱 또는 매트라스 A의 내부 벽에 물이 축적됩니다. 물은 점차 많아져 큰 물방울을 이루며 발롱의 바닥으로 모입니다.
실험 전후의 발롱을 무게 재기를 통해 수집된 물의 양을 측정할 수 있습니다. 이는 실험에서 사용된 가스의 무게와 생성된 물의 무게가 같아야 함을 확인하는 두 가지 검증 방법을 제공합니다.
마무리
라부아지에의 연구와 이론은 현대 화학의 근간을 형성했습니다. 그는 원소를 금속과 비금속으로 체계적으로 분류하고, 이를 바탕으로 화합물 형성과 화학 반응을 설명했습니다. 그의 주요 저서 "Traité Élémentaire de Chimie"는 질량 보존의 법칙과 화학적 명명법을 체계적으로 설명하며, 현대 화학의 기초를 다졌습니다. "Mémoire sur la combustion en général"에서는 연소가 산소와의 화학 반응임을 증명하고, "Réflexions sur le Phlogistique"에서는 플로지스톤 이론을 비판하며 새로운 이론을 제안했습니다. 그의 아내는 남편의 연구를 지속적으로 홍보하며 파리의 과학계에서 중요한 역할을 했습니다. 라부아지에의 체계적 분류와 명명법은 화학자들이 물질의 특성과 화학 반응을 이해하고 예측하는 데 큰 도움을 주었습니다.
이 블로그는 라부아지에의 생애와 업적, 그리고 그의 연구가 현대 화학에 미친 영향을 조명합니다. 라부아지에의 혁신적인 연구 방법론과 발견은 오늘날의 화학 연구와 교육에 여전히 중요한 영향을 미치고 있습니다. 그의 업적을 통해 화학의 복잡한 원리를 보다 쉽게 이해할 수 있게 되었습니다.
